Ludwig Wilhelm Winkler /Lajos Winkler (1888) විසින් ඔහුගෙ ආචාර්ය උපාධිය සඳහා වන නිබන්දනය සකසන අතරතුරේ ,පලමුව ඉදිරිපත් කරන ලද මෙම පරීක්ෂණය Strickland and Parsons (1968) විසින් පසුව නවීකරණය කරන ලදී. ජලයේ ද්රාවිත ඔක්සිජන් (DO) ප්රමානය ,ජල ස්කන්ධ එහෙමත් නැත්තම් water masses වල ජෛවීය ක්රියාකරිත්වයේ මිනුමක් වෙනවා. ජල ස්කන්ධ වල සිටින ශාක ප්ලවාංග (phytoplanktons) හා ඇල්ගී විසින් ප්රභාසංස්ලේෂනය (photosynthesis) මගින් ඔක්සිජන් නිපදවා ජලයට මුදා හරිනවා. ජලයේ වෙසෙන බැක්ටීරියා හා සූන්යෂ්ටික(eukaryotic) ජීවින් ( සත්ව ප්ලවාංග, ඇල්ගී, මත්ස්යින්) විසින් ශ්වසනය මගින් මෙම ඔක්සිජන් පරිහරණයට ලක්වෙනවා. මෙම යාන්ත්රන දෙකෙහි ප්රතිඵලයක් ලෙස ජලයේ ද්රාවිත ඔක්සිජන් ප්රතිශතය තීරනය වෙනවා වගේම, එමගින් ජෛවස්කන්ධ (biomass) නිෂ්පාදනය පෙන්නුම් කරනවා. ජලයේ භෞතික ඔක්සිජන් සාන්ද්රණය හෙවත් ජලයේ කිසිදු ජීවියෙක් නොසිටී නම් පවතින සෛද්ධාන්තික ඔක්සිජන් සාන්ද්රණයේ අගයෙහි හා ජලයේ සැබැ ඔක්සිජන් සාන්ද්රනයේ අගයෙහි වෙනස ජෛව ඔක්සිජන් ඉල්ලුම (Biological Oxygen Demand/ BOD) ලෙස අර්ථ දැක්වෙනවා. ජලයේ ඇති nitrate හා phosphate ඉහල BOD අගයක් ඇති කිරිම්ට සමත් වෙනවා. ඒවා ශාක පෝෂක වන බැවින් ඇල්ගී හා වෙනත් ජලජ ශාක වල ඉක්මන් වර්ධනය ඇති කරයි. මෙලෙස ශාක ඉක්මනින් වර්ධනය වෙනවා වගේම ඉක්මනින් විනාශ වීමද සිදු වෙනවා. එමගින් ජලයේ කාබනික අපද්රව්ය ප්රමාණය වැඩිවී ඒවා බැක්ටීරිය මගින් වියෝජනය වේ. මෙම ක්රියවලිය මගින් ජලයේ BOD අගය සීග්රයෙන් වැඩිවේ.
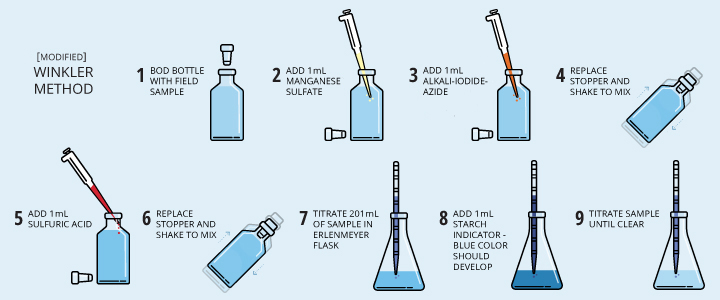
ජල සාම්පල වල ද්රාවිත ඔක්සිජන් මට්ටම තීරණය කිරීමට හා ජල සාම්පලයේහි ජෛව ක්රියකරිත්වය නිමානය කිරීමට වින්ක්ලර් ක්රමය යොදගන්නවා. මුලින්ම Manganese(II) ලවණ, iodide (I-) and hydroxide (OH-) අයන අතිරික්ත ප්රමාණයක් ජල සාම්පලයට යෙදීමෙන් සුදු පැහති Mn(OH)2 අවක්ෂේපය ලබාගන්නවා. ජලයේ ද්රාවිත ඔක්සිජන් මගින් මෙම අවක්ෂේපය දුඹුරු පැහැති මැංගනීස් අවක්ෂේපයක් [manganic hydroxide (MnO(OH)2) ]බවට ඔක්සිහරණයට ලක් කෙරෙනවා. ඊලඟ පියවරේදි මෙයට ප්රබල අම්ලයක් (phosphoric acid) එක්කිරීමෙන් ද්රාවණය ආම්ලික කරගැනීමක් සිදුවෙනවා. ඉන්පසුව දුඹුරු අවක්ෂේපය මගින් Iodide අයන Iodine බවට පත් කෙරෙනවා. එම Iodine, thiosulphate සමග අනුමාපනයක් මගින් ජලයේ ද්රාවිත ඔක්සිජන් ප්රමානය සොයගැනීම සිදු කරනවා. මෙහි අන්ත ලක්ෂ්ය තීරණය කිරීමට පිෂ්ඨය දෘෂ්ය දර්ශකයක් ලෙස යොදාගන්නවා.
පලමුව ජල සාම්පලයට Manganese(II) sulfate ද්රාවණය යොදන අතර ඉන්පසු Potassium iodide යෙදීමෙන් රෝස පැහයට හුරු දුඹුරු පැහති අවක්ෂේපයක් ලබාගනී. භාෂ්මික ද්රාවණයෙදී ද්රාවිත ඔක්සිජන් මගින් manganese(II) අයන චතුර්සංයුජ අවස්තාවට ඔක්සිහරණය කරයි.
2 Mn(OH)2(s) + O2(aq) → 2 MnO(OH)2(s)
MnO(OH)2 දුඹුරු අවක්ෂේපයක් ලෙස ප්රදර්ශනය වේ. මෙහිදී ඇති වෙන ප්රශ්නයක් තමයි ඔක්සිකෘත manganese පවතින්නේ චතුර්සංයුජ අවස්ථවේද ත්රී සංයුජ අවස්ථාවේද යන්න. සමහර මූලාශ්ර වලට අනුව Mn(OH)3 දුඹුරු අවක්ෂේපය වන අතර නමුත් සජල MnO2 මගින්ද දුඹුරු පැහැය ගෙන දිය හැක.
4 Mn(OH)2(s) + O2(aq) + 2 H2O → 4 Mn(OH)3(s)
වින්ක්ලර් ක්රමයේ දෙවන කොටසෙහිදී ද්රාවණය ආම්ලික කිරීමක් සිදු කරන අතර එමගින් දුඹුරු පැහැ අවක්ෂේපය ද්රාවණය කිරීමක් සිදුවේ. අම්ලය මගින්, දුඹුරු අවක්ෂේපය Iodide අයන Iodine බවට පත්කිරීම පහසු කරවයි.
2Mn(OH)3(s) + 2I– (aq) + 6H+(aq) → 2Mn2+ (aq) + I2 (aq) + 6H2O(l)
මෙම Iodine, thiosulphate සමග අනුමපනය කරයි.
2 S2O32-(aq) + → S4O62-(aq) + 2 I–(aq)
අයන ස්ථයී නොවන නිසා හෝ ස්ථයී බවින් අඩු නිසා එය primary standard එකක් සමග ප්රාමානීකරණයකට ලක් කිරීමක් සිදු කල යුතුය. සාමන්යයෙන් potassium iodate (KIO3) සමග මෙම ප්රතික්රියාව සිදු කරයි. මෙහිදී iodide සමග iodate ද්විධාකරණ ප්රතික්රියාවක් සිදුවේ.
IO3–(aq) + 8I– (aq) + 6H+ (aq) → 3I3– (s) + 3H20(l)
ඉහත ස්ටොයිකියොමිතික සමීකරණ මගින් පහත සම්බන්ධය ලබාගත හැක.
1 mole of O2 → 4 moles of Mn(OH)3 → 2 moles of I2→4moles of S2O32–
මෙමගින් ලබගන්නා ඔක්සිජන් අන්තර්ගතය mg dm-3 ට හෝ ppm ආකාරයට ප්රකාශ කරයි.
I2හා වැඩිපුර ඇති I– එකතු වීමෙන් I3– යන සංකීර්ණය සෑදෙයි. I2 හා I3– සංකීර්ණය අතර සම්තුලිතතාවත් පවතින අතර, I3- , I2 සංචිතයක් ලෙස ක්රියා කරයි.
I2(aq) + I-(aq) ↔I3-(s)
ජලයේ ද්රාවිත ඔක්සිජන් විශ්ලේෂණය ගංඟා, වැව් ආදී ජල සම්පත් වල පිරිසිදු බව හා සෞඛ්යාරක්ෂිත බව නිර්ණය කිරීමට, මිරිදිය පද්ධති අනුබල දෙන ජෛව ස්කන්ධ ප්රමණය හා වර්ගය නිර්ණයට, ගංඟා, වැව් වල සිදු වන වියෝජන ප්රමණය නිර්ණයට උපකාරී වේ.
මෙම පරීක්ෂණයේ නිරවද්යතාවයට බලපාන සීමකාරී කරුණු කිහිපයක්ම පවතී. වැදගත් කරුණ නම් මෙහි සාර්තකත්වය වැඩි වශයෙන් රඳා පවතින්නේ යොදගන්නා ජල සාම්පලය හසුරුවන ආකරය මත වීමයි. එනම් කිසිදු පියවරකදී ජල සාම්පලයට අලුතෙන් ඔක්සිජන් එකතු වීමත්, සාම්පලයෙහි තිබෙන ඔක්සිජන් ඉවත් නොවීමත් සිදු විය යුතුය වීමයි. තවත් කරුණක් නම් Iodine ඔක්සිහරණය හෝ ඔක්සිකරණය කරන කිසිදු ද්රාව්යයක් සාම්පලයෙහි නොතිබිය යුතුය.
ජල සාම්පලය බෝතලයට පුරවා ගැනීමේදී air bubbles නොරැඳෙන ලෙස පුරවා ගත යුතු අතර හා භාෂ්මික iodide–azide එකතු කිරීමේදී පිපෙට්ටුව බෝතලය තුලට ඇතුල් කර එකතු කරගත යුතු වේ. ප්රතිකාරක එකතු කිරීමේන් පසුව ප්රතික්රියව හොදින් සිදුවීම සඳහා බෝතලය හොඳින් සෙලවිය යුතුය.අම්ලය එක් කිරීමෙන් පසු සෑදීමේ ප්රතික්රියව සිදු වන නිසා බෝතලය ආලෝකය නොවැටෙන ලෙස කලුවර ස්ථානයක තැබීමක් සිදු කරයි. මන්ද යනු Iodine අලෝකයට ඉතාමත් සංවේදී, අලෝකය හමුවේ Iodide අයන I2 බවට පත්වෙන ප්රතික්රියාව ඉක්මන් වෙන රසායනික ද්රව්යක් නිසාවෙනි.
පිෂ්ඨය දර්ශකය එකතු කල යුතු වන්නේ Iodine සාන්ද්රණය ඉතාමත් අඩු අනුමාපනයේ අන්ත ලක්ෂය ආසන්නයේදි නැතහොත් ද්රාවණය ලා කහ පාටට පත් වීමෙන් අනතුරුවයි.එසේ නොමැති වුවහොත් පිෂ්ඨය මතට Iodine දැඩිව අධිශෝෂණය වීමෙන් ජලයෙහී අද්රාව්ය සංකීර්ණයක් සෑදීම නිසා ප්රතික්රියාව මන්දනය වීමක් හා අන්ත ලක්ෂ්ය හඳුනා ගැනීමට අපහසු වීමක් සිදු වන නිසාවෙනි. ඉහල උෂ්ණත්ව වලදි පිෂ්ටය මතට අධිශෝෂණය වීම අඩු වන නිසා අනුමපනය සිදු කල යුතු වන්නේ අඩු උෂ්ණත්ව තත්ව යටතේදීය.